Кислород – один из наиболее распространенных элементов на Земле, который является жизненно важным для множества организмов. Его химический символ O и атомный номер 8 говорят о его месте в периодической системе химических элементов. Кислород обычно присутствует в атмосфере в виде двуокиси кислорода (O2), но существует и ряд редких состояний, в которых окислительное число кислорода превышает 2.
Одним из таких редких и особенных состояний кислорода является озон. Озон (O3) является сильным окислителем и эффективно уничтожает бактерии и грибки. Встречается озон как в атмосфере Земли, где он защищает нас от вредного ультрафиолетового излучения, так и в нижних слоях атмосферы, где он является одним из причин смога.
Еще одним интересным состоянием кислорода с окислением выше 2 является пероксид водорода (H2O2), или перекись водорода. Это очень реактивное вещество, которое используется в медицине как антисептик и водородном пропелланте для ракет. Перекись водорода также может беспрепятственно реагировать с органическими веществами, поэтому она хранится в темных и непроницаемых контейнерах.
Изменение окисления: особенное поведение кислорода в необычных состояниях
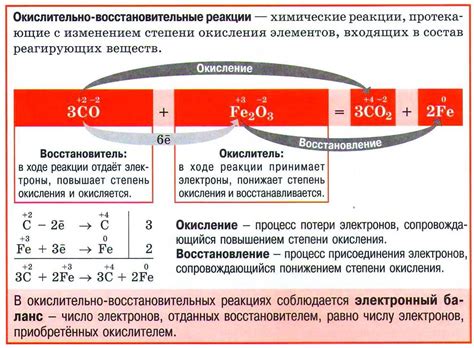
Кислород, один из самых распространенных элементов на Земле, обычно существует в стабильном окислительном состоянии -2. Однако, в определенных условиях, кислород может изменять свое окисление и принимать более высокие значения.
Наиболее известным примером такого поведения является формирование озона, трехатомной молекулы кислорода (O3), в стратосфере Земли. Озон играет важную роль в защите от УФ-излучения, поглощая опасные ультрафиолетовые лучи и предотвращая их достижение поверхности планеты.
Кроме того, возможно образование перекиси водорода (H2O2) и озонида калия (KO3). Перекись водорода широко известна своими окислительными свойствами и может использоваться в качестве антисептика и отбеливателя. Озонид калия является крайне нестабильным и взрывоопасным веществом, но его образование представляет научный интерес и служит основой для различных экспериментов и исследований.
Изменение окисления кислорода имеет важные физические, химические и биологические последствия. Оно может приводить к образованию новых соединений и реакций, которые в противном случае были бы невозможны. Понимание этого уникального поведения кислорода является ключевым для развития новых материалов, катализаторов и технологий, а также для изучения и улучшения здоровья и окружающей среды.
Редкое явление: кислород с окислением выше 2

Однако существуют редкие и особенные случаи, когда кислород образует соединения с окислением выше 2. Эти состояния кислорода называются "высокоокислительными" и могут быть очень необычными и неустойчивыми.
Озон (O3) - один из самых известных примеров кислорода с окислением выше 2. Он образуется под воздействием ультрафиолетового излучения на кислород в стратосфере Земли и служит естественным щитом от вредного ультрафиолетового излучения солнца.
Пероксины (O4, O6, O8 и т.д.) - это еще более высокоокислительные соединения кислорода. Они образуются в экспериментальных условиях при очень высоких температурах и давлениях, и были обнаружены только в лаборатории.
Высокоокислительные формы кислорода могут быть использованы в различных процессах и технологиях, таких как окислительные реакции, электрохимические процессы и синтез различных соединений.
Однако из-за их нестабильности и редкости, высокоокислительные соединения кислорода изучаются в основном с целью расширения наших знаний о химических свойствах и реакциях этого важного элемента.
Удивительные свойства кислорода в высоких окислительных состояниях

Когда кислород окисляется выше указанного значения, происходят удивительные преобразования и его свойства становятся совершенно иными. Наиболее известной формой кислорода с окислением выше 2 является озон (O3), который обладает ярким запахом и способностью действовать как мощный окислитель.
Кроме озона, существуют и другие состояния кислорода с окислением выше 2. Например, пероксид водорода (H2O2) - бесцветная жидкость с сильным оксидирующими свойствами и широким спектром применения в медицине и промышленности.
Кислород с окислением выше 2 также обладает особенными свойствами, когда его включают в металлические соединения. К примеру, в пероксидах металлов, таких как пероксид бария (BaO2) или пероксид бария (BaO2), кислород выполняет роль сверхокиси.
Удивительно, но кислород с окислением выше 2 может формировать стабильные соединения даже с инертными газами. Такие соединения, например, ксенон-оксиды (XeO3, XeO4, XeO6), обладают необычными физическими свойствами и могут быть использованы в качестве мощных окислителей.
Необычные соединения: кислород в состояниях с окислением выше 2

Один из таких примеров - супероксидный ион (O-2). В этом случае, кислород находится в состоянии с окислением -1. Супероксидный ион образуется при взаимодействии кислорода с электроном или при окислении соответствующих соединений.
Другим необычным соединением является пероксидный ион (O-12), в котором кислород имеет окисление -1. Пероксидные соединения образуются при взаимодействии кислорода с веществами, содержащими водород (например, перекись водорода - H2O2).
Кислород также может образовывать пероксоангидриды, в которых он имеет окисление +1. Это соединения с двумя кислородными атомами, связанными между собой. Примером таких соединений является пероксоборатный ион (BO3-2), содержащий две пероксоангидридные группы.
Кислород в состояниях с окислением выше 2 является редким и необычным явлением в химии. Такие соединения имеют специфические свойства и могут быть использованы в различных областях, таких как медицина или катализ.
В итоге, кислород обладает разнообразием окислительных состояний, позволяющих ему участвовать в различных химических реакциях и создавать необычные соединения, открывая новые возможности для науки и промышленности.
Практическое применение: изучение и использование редких состояний кислорода

Изучение и использование редких состояний кислорода имеет множество практических применений в различных областях науки и технологий. Эти состояния кислорода открывают новые возможности для создания новых материалов, разработки новых технологий и улучшения существующих процессов.
Одним из основных направлений применения редких состояний кислорода является исследование и создание новых материалов с уникальными свойствами. Кислородные соединения с высоким окислением могут образовывать сложные структуры, которые могут быть использованы в качестве катализаторов, наноматериалов, материалов для электроники и других областей.
Еще одним применением редких состояний кислорода является исследование химических реакций и процессов, в которых участвует кислород. Такие исследования помогают лучше понять механизмы химических реакций и разработать новые способы их управления и оптимизации.
Более конкретные примеры практического применения редких состояний кислорода включают разработку новых методов химического синтеза, использование в энергетике, создание эффективных катализаторов для промышленности, улучшение производительности батарей и солнечных батарей, исследование возможностей использования кислорода в медицине и многое другое.



